干细胞与糖尿病
文章来源:市场部滕经理 发布时间:2020-06-15
.jpg)
近日,《英雄联盟》职业选手Uzi(简自豪)因身患II型糖尿病宣布退役,这个在英雄联盟界作为神一样的男人因为常年压力大、肥胖、饮食不规律、熬夜等原因,去年查出II型糖尿病,糖化血红蛋白指数达11%。
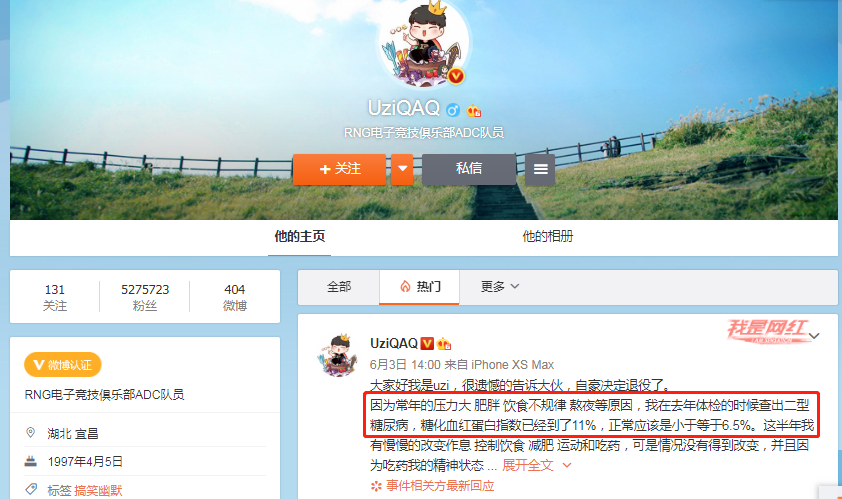
伴随着这位传奇选手的退役,又一次将糖尿病推上了热搜,并被广泛热议。
糖尿病导致血液中的葡萄糖水平过高,其发病与包括遗传、肥胖、年龄增长和缺乏运动等诸多因素有关。胰岛素是由胰岛β细胞所分泌的降血糖激素,随着年龄的增长,胰岛β细胞的功能也日渐衰退,到了一定的时候,即使没有爆发糖尿病,胞内控制细胞生长的遗传开关(genetic switches)也不能像年轻时那样有效地感受外界信号、执行分泌胰岛素分泌的功能。

1型糖尿病是由于体内免疫复合物的攻击导致胰岛β细胞被破坏、胰岛素分泌绝对不足;2型糖尿病约占所有糖尿病的90%,是由各种原因(包括遗传、环境等因素)导致的胰岛素抵抗与胰岛素分泌不足(或相对不足)。
目前糖尿病尚无针对病因的治疗方法且常规治疗都有一定的副作用,使患者维持平稳血糖的治疗方案会比较复杂且无法阻止病情的进一步发展。
2型糖尿病(type 2 diabetes mellitus,T2DM)的主要特征是胰岛β细胞功能障碍和不同程度的胰岛素抵抗,导致无法维持血糖稳态。T2DM的理想治疗方法是改善外周胰岛素抵抗同时促进胰岛β细胞再生。补偿和恢复胰岛β细胞的功能是最有前景的方法。这种方法能控制血糖水平,并从成体细胞再生出具有分泌胰岛素功能的胰岛β细胞。
近年来,基于细胞的替代疗法展示了在糖尿病(diabetes mellitus,DM)治疗上的优势。间充质干细胞(mesenchymal stem cells,MSCs)具有多向分化潜能,低免疫原性、免疫调节作用、抗炎作用和抗凋亡作用等特性,能通过提供由旁分泌因子分泌或细胞外基质沉积驱动的支持性微环境,促进胰岛β细胞的再生,保护内源性胰岛β细胞免于凋亡,并改善外周组织的胰岛素抵抗。因此被认为是治疗DM的理想候选细胞类型。
MSCs治疗糖尿病的机制可能为以下几种:
将MSCs诱导分化成胰岛素分泌细胞(insulin-producing cells,IPCs),促进胰腺再生和减轻胰岛素抵抗,为糖尿病治疗中胰岛细胞移植提供替代方案。
MSCs还可以迁移到受损胰岛细胞,分泌具有旁分泌和自分泌活性的多种细胞因子和生长因子参与胰岛细胞的修复,从而促进胰岛β细胞的再生。
MSCs能针对性地分化为胰岛β样细胞。这些细胞具有典型的β细胞形态学特征,并表达与内分泌胰腺发育和功能有关的转录因子和其他基因。
同时,MSCs还能促进胰岛α细胞向β细胞的转分化。
MSCs具有低免疫原性和免疫调节的性质,能保护胰岛β细胞,减少因自身免疫导致的损伤。
 .
.
在临床研究中,干细胞治疗使用的注射剂量与治疗效果之间存在直接关系。临床研究中表明,注射高剂量(200~400 mL)的自体骨骼MSCs,治疗效果更佳。最近的研究也证实了同种异体BM-MSC治疗T2DM的剂量反应关系,在使用0.3×106 ~2.0×106个/Kg的MSCs进行治疗后,表明注射较高剂量的干细胞治疗效果更佳。然而,研究只有3个月的随访,并且治疗剂量的选择需要从多方面进行考虑,如MSCs的类型、细胞传递的途径、MSCs的生存能力和纯度以及患者的病情等。
研究者仍需要进一步探索,以确定在设计良好、剂量递增的临床试验中最安全、有效的最适细胞剂量。此外,给药的间隔和频率也需要进一步优化。考虑到单次给予MSCs可能不足以维持长期的治疗效果,对多次注射MSCs进行了许多临床研究,一般为注射2~4次,间隔2~12周。结果显示,多次注射后,患者的胰岛素剂量需求进一步降低,可能产生更持久的治疗效果。因此,需要对MSCs注射的最佳时间、频率和间隔进行深入的研究,以寻求最佳的治疗方案。
这些研究表明,干细胞可能代表了一种无限的细胞来源,MSCs能有效治疗T2DM,但是在临床应用上仍存在很多问题需要进一步探究。目前,《“干细胞及转化研究”国家重点研发计划》支持“细胞移植治疗代谢系统重大疾病”。重点在于找到最佳的细胞传递途径和技术,寻找获得理想治疗效果所需细胞的最佳类型和数量,并找出归巢特征与治疗效果之间的关系。随着研究的开展,干细胞治疗糖尿病有望取得更大突破。



